Kén
Sablon:Kén/Táblázat A kén a periódusos rendszer VI.A csoportjába tartozó nemfémes kémiai elem. Vegyjele S, rendszáma 16. Régies magyar elnevezése a kéneny.[1] Standard nyomáson és hőmérsékleten szagtalan, élénksárga színű kristályokat alkot, melyek nyolcatomos gyűrűs molekulákból épülnek fel. A kén multivalens, vagyis változó vegyértékű elem, és az aranyat, platinát, iridiumot, nitrogént, tellúrt, jódot és a nemesgázokat leszámítva az összes többi elemmel képez vegyületet.
A kén előfordul a természetben elemi (terméskén) formában is, de leginkább vegyületei – főként szulfid- és szulfát-ásványok – formájában található meg. A kén az egyik legrégebben ismert elem, felhasználták már az ókori Indiában, Kínában, Egyiptomban és Görögországban is. Manapság majdnem az összes elemi ként a földgázban és kőolajban lévő kéntartalmú szennyezőanyagok eltávolításakor, melléktermékként nyerik. A ként legnagyobb mennyiségben kénsav gyártására használják, amely szulfát- és foszfátműtrágyák előállításához, valamint számos vegyi eljáráshoz szükséges alapanyag. Elemi kén található gyufákban, rovar- és gombaölő szerekben. Számos kénvegyület erős szagú, kénvegyületek kölcsönzik többek közt a grapefruit és a fokhagyma szagát, és kéntartalmú tiolokkal szagosítják a földgázt is.
A kén az élet minden formája számára esszenciális elem. Legtöbbször szerves kénvegyületek, vagy fém-szulfidok formájában. Három aminosav – a cisztein, cisztin és a metionin, valamint két vitamin – a biotin és a tiamin is tartalmaz ként. Számos kéntartalmú kofaktor létezik, többek közt a glutation, vagy a tioredoxin. Két kénatom közt létrejött úgynevezett diszulfid-hidak nagy mechanikai szilárdságot és oldhatatlanságot kölcsönöznek a bőrben, hajban és tollakban megtalálható keratinnak.
Nevének eredete
Vegyjele a latin sulfur szó kezdőbetűjéből származik. E név eredetére két magyarázat kínálkozik, az egyik az indoeurópai suelphlos-ra vezeti vissza, ami a swel (lassan égni) kifejezésből ered. Korábban viszont úgy gondolták, hogy a szanszkrit sulver-ból (a réz ellenségéből) ered.[2]
Jellemzői
A természetben elemi állapotban is előfordul vulkángőzökben, fontosabb – a természetben megtalálható – vegyületei a szulfátok és a szulfidok. Az élethez elengedhetetlenül szükséges és több aminosavban megtalálható. A levegőbe kerülő kén-dioxid (SO2) a környezetre nagyon veszélyes savvá, például kénsavvá (H2SO4) alakulhat. Ezek a csapadékok visszajutnak a felszínre, ez a savas eső.
Keletkezése
Kétféleképpen keletkezik: a kőolaj-finomítás melléktermékeként, vagy a vulkánkitörések után, amikor már csak gőzölög a vulkán, akkor ebből a kigőzölgésből kicsapódik. A legnagyobb lelőhelyei így olyan országokban vannak, ahol sok a vulkán, például az USA-ban, Szicíliában, Peruban, Chilében, Japánban, vagy Mexikóban.
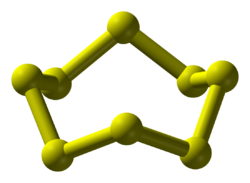
Fizikai tulajdonságai
- Számos (több mint 30) allotrop módosulata ismert, ezek közül a három legjelentősebb:
- Rombos kén: ez a szobahőmérsékleten stabil, szilárd állapota; 8 atomos molekulái molekularácsban helyezkednek el.
- Monoklin kén: a 95,5 °C fölött stabil állapot; hosszúkás, tűszerű kristályok keletkeznek.
- Amorf kén: metastabil; kristályrács nélküli, olvasztás után hirtelen lehűtött (túlhűtött) folyadék; 95,5 °C fölött monoklinné, az alatt rombossá alakul.
- Színe mindhárom módosulatban sárgás.
- Olvadás- (115,21 °C) és forráspontja (444 °C) viszonylag alacsony.
Kémiai tulajdonságai
A kén a fémekkel fém-szulfidokká egyesül.
A kén a cinkkel cink-szulfiddá egyesül. Ez sárgásfehér, szilárd anyag.
- Zn + S → ZnS
A kén a vassal vas(II)-szulfiddá egyesül. Ez fekete, szilárd anyag.
- Fe + S → FeS
A kén a higannyal higany-szulfidot alkot. Ez az anyag nem mérgező, sötétszürke színű.
- Hg + S → HgS
A kén kék színű lánggal ég. Égésekor kén-dioxid keletkezik.
- S + O2 → SO2
Szénnel magas hőmérsékleten szén-diszulfidot (szénkéneg) ad.
- C + 2 S → CS2
Hidrogénnel is reagál. Ekkor hidrogén-szulfid keletkezik.
- H2 + S → H2S
Halogénekkel eltérő összetételű vegyületeket alkot, jód nem hat rá. Az erélyesen oxidáló hatású fluorgázban kén-hexafluoriddá ég el, amit elektromos szigetelőként használnak.
- S + 3 F2 → SF6
Klórral dikén-diklorid keletkezik. Ez egy sárga színű, büdös szagú folyadék.
- 2 S + Cl2 → S2Cl2
Felhasználása
A kén a só, a mészkő, a szén és a kőolaj mellett a vegyipar öt legfontosabb alapanyaga közé tartozik. A kén 85%-ából kénsavat állítanak elő. A kénsavat műtrágyagyártáshoz használják. Sablon:Forrás Mintegy 10%-át elemi állapotban használják: fehérítőszerként a textil- és papíriparban, a gumigyártásban, növényvédő szerként lisztharmat ellen, gyufagyártásra, lőpor, gyógyszerek és kozmetikai készítmények előállítására.
Kénezés: a borászatban az üres hordók eltartásánál és a bor kezelésénél használjuk. A kénezés rendszerint úgy történik, hogy a hordóban egy kénszeletet elégetnek. A kén a levegő oxigénjével vegyül és kén-dioxiddá lesz, mely aránylag csekély mennyiségben is sokféle, a bor betegségét okozó baktériumra méregként hat.
- Kén égése oxigénben, kén-dioxid képződése közben.
Az élelmiszerek csomagolásán gyakran találkozunk az E-számokkal. Például ilyen a kén-dioxid (E220), ami a tartósítószerek közé tartozik.
Jegyzetek
Források
További információk
- a magyar Wikipédia ként tartalmazó vegyületeinek listája külső keresővel