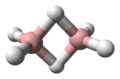Boránok

A boránok a BxHy képletű vegyületek és a kapcsolódó anionok. Számos borán ismert. A leggyakoribbak az 1–12 bóratomot tartalmazók. Noha kevés gyakorlati alkalmazásuk van, a boránok szerkezete jelentősen különbözik a szénhidrogénekben láthatóktól. A boránok és a szénhidrogének „hibridjei”, a karboránok is ismertek.[1]
Történet
A boránok kémiájának fejlődésével a szintézis és a szerkezet terén újabb módszereket fedeztek fel. Először új szintézisekre volt szükség a diborán és számos származéka kezelésére, mivel pirofórosak és illékonyak. Alfred Stock ezért feltalálta az üveg vákuumcsövet.[2]
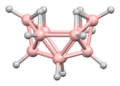
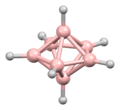
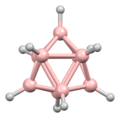
A diborán szerkezetét 1943-ban, évekkel felfedezése után helyesen jósolták meg.[3] A bórhidrogén klaszterek szerkezetét 1948-ban kezdték meghatározni a dekaborán jellemzésével. William Lipscomb 1976-ban ezért és sok későbbi krisztallográfiai vizsgálatáért elnyerte a kémiai Nobel-díjat. Ezek a vizsgálatok deltaéderes szerkezeteket, BH központok háromszögletű csoportjait mutatták ki. --> A klaszterek kötései a poliéderes vázelektronpár-elméletből és a Wade-szabályokból következnek, amik a boránok szerkezeteinek előrejelzésére használhatók.[4] E szabályok határozzák meg számos klasztervegyület szerkezetét.
A boránok iránti érdeklődés a második világháború idején megnőtt az urán-borohidrid urándúsítási képességei miatt és az időjárásjelző ballonok hidrogénforrásaként. Az Amerikai Egyesült Államokban egy Hermann Irving Schlesinger által vezetett kutatócsoport az anionos bórhidrogének és a megfelelő alumíniumhidrogének kémiáját fejlesztette ki. Munkája a szerves szintézisben használt számos bórhidrogén reagens alapja volt, melyek legtöbbjét diákja, Herbert C. Brown fejlesztett ki. A boránalapú reagenseket mára széles körben használják szerves szintézisekhez. 1979-ben Brown munkásságáért megnyerte a kémiai Nobel-díjat.[5]
Képletük és elnevezésük
A boránokat az alábbiak szerint csoportosítják, ahol n a bóratomok száma a vegyületben:[6][7][8]
| Klasztertípus | Általános képlet | Példa | Megjegyzések |
|---|---|---|---|
| hiperklozo- | BnHn | Instabil, származékai ismertek[9] | |
| klozo- | Sablon:Chem | Cézium-dodekaborát | |
| nido- | Sablon:Chem | pentaborán(9) | |
| arachno- | Sablon:Chem | pentaborán(11) | |
| hifo- | Sablon:Chem | Csak adduktumokban található |
A boránok szabályos neve a vegyület típusát jelző előtaggal kezdődik, amit a bóratomok száma követ, végül a hidrogénatomok száma található zárójelekben. Egyes részletek elhagyhatók, ha egyértelmű a jelentés, például ha csak egy szerkezeti típus lehetséges. Néhány példa:
-
izo-Sablon:Chem
-
Hexaborát(6)
Sablon:Chem -
Heptaborát(7)
Sablon:Chem -
Oktaborát(8)
Sablon:Chem -
Nonaborát(9)
Sablon:Chem -
Dekaborát(10)
Sablon:Chem -
Undekaborát(11)
Sablon:Chem
Az anionok nevezéktanára példa az oktahidridopentaborát, Sablon:Chem. A hidrogének száma van elöl, amit a bóratomszám követ. Az -át végződés az anionok nevének végén található. A töltés csak a képlet része, nem a szabályos névé.
A boránok kötései
A boránok nem klasszikusan kötött vegyületek: nincs elég elektron minden szomszédos atompár közti 2 központú, 2 elektronos kötésekhez. A nagyobb boránok kötéseit William Lipscomb írta le. Ebben az alábbiak szerepeltek:
- 3 központú, 2 elektronos B–H–B hidak
- 3 központú, 2 elektronos B–B–B kötések
- 2 központú 2 elektronos kötések (B–B, B–H, Sablon:Chem)
Lipscomb módszertanát nagyrészt leváltotta egy molekulapálya-alapú megközelítés, lehetővé téve a több központú kötések bővítését. Például az ikozaéderes Sablon:Chem ionban a teljesen szimmetrikus (Ag szimmetriájú) molekulapálya a 12 bóratom közt egyenlően oszlik el. A Wade-szabályok jó módszert adnak a szerkezetek számításához atomszámuk és -kapcsolataik tekintetében.
Többklaszteres boránok

Bár ritkák, néhány többklaszteres boránt leírtak. Például egy borán Sablon:Chem-nal (Sablon:Chem-forrásként) való reakciója konjunkto-boránt ad, ahol a boránalegységeket megoszló bóratomok kapcsolják össze.[11]
Más konjunkto-boránok, ahol az alegységeket B–B kötés kapcsolja össze, nido-boránok ultraibolya besugárzásával készíthetők. Néhány B–B kapcsolt konjunkto-borán előállítható Sablon:Chem katalizátorral.[12]
A Wade-szabályok mintájára elektronszámláló séma jött létre a többklaszteres boránok feltételezésére.
| Előtag | Jelentés | Példa |
|---|---|---|
| klado- | elágazó csoportok | |
| konjunkto- | Összekapcsolt csoportok | |
| megalo- | több összekapcsolt csoport |
Boránok reakciókészsége
A borán (Sablon:Chem) csak átmenetileg létezik, mielőtt dimerizálódik diboránt (Sablon:Chem) adva. Adduktumai, a Sablon:Chem·THF és a Sablon:Chem·DMSO elég stabilak a hidroborációban való használhatósághoz. A diborán viselkedéséhez hasonlóan néhány kisebb borán reakciója a levegővel nagyon exoterm, akár robbanásszerű is lehet. Ezzel szemben sok klozo-borán, például a Sablon:Chem nem reagál a levegővel.
A bór-hidridklaszterek sokszínűsége miatt nem lehet reakcióikat általánosítani.
Lewis-savként/bázisként
Egyesek elektrondonorként viselkednek a B–Hterm csoportok viszonylagos bázikussága miatt. A boránok koordinációs vegyületekben ligandumok lehetnek.[14] η1–η6 hapticitásokat találtak, az elektrondonáció a hídhidrogéneket és a B–B kötéseket is érintheti. Például a Sablon:Chem a Zeise-sóban helyettesítheti az etént, e vegyület a Sablon:Chem.
Lewis-savként is működhetnek a klaszter megnyílásával. Például trimetilfoszfinnal:
Brønsted-savként/bázisként
Néhány nagyobb borán, különösen a hídhidrogénnel rendelkezők, deprotonálhatók erős bázissal. Például:
A savasság a borán méretével nő.[15] A Sablon:Chem savassága 2,7.[* 1]
Aufbau-reakciók
Fontos reakciók még a felépítő folyamatok, ahol a kisebb bórhidrogénklaszterek nagyobbakká egyesülnek boránaddícióval.
Hidroboráció
A diboránhoz és adduktumaihoz hasonlóan a nagyobb boránok hidroborációban vesznek részt. Alkinaddíciókor a szén a klaszter részévé válik, karboránokat (például Sablon:Chem) létrehozva.[16]
Alkalmazásai
A diborán és monomeradduktumai, a borán–tetrahidrofurán és a borán–dimetil-szulfid hasznos reagensek. Gyakran használják hidroborációhoz. Néhány nagyobb borán, például az anti-Sablon:Chem lumineszcens.[17] A karboránok egyes kobaltszármazéka elkülöníti a radioaktív hulladékból a [[cézium-137|Sablon:Chem]]-et.[18]
Lehetséges alkalmazások
Mivel a boránok könnyen elnyelnek neutronokat, származékait sokat vizsgálták neutronbefogásos rákterápiában való használatra.[19] Sokat használt vegyület a Sablon:Chem. Itt felhasználják, hogy a Sablon:Chem neutronbefogási hatáskeresztmetszete nagyon nagy, így a neutronsugárzás erősen szelektív a vegyületet tartalmazó helyre.
A boránok fűtőértéke a szénhidrogénekkel összehasonlítva magas, lehetséges üzemanyagokká téve. Az 1950-es években nagymértékben kutatták üzemanyag-adalékokként, de gyakorlati eredmények nem jelentek meg.
Megjegyzések
Hivatkozások
Fordítás
Sablon:Nemzetközi katalógusok Sablon:Portál
- ↑ * Sablon:Cite book
- ↑ Sablon:Cite book
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Brown, H. C. Organic Syntheses via Boranes John Wiley & Sons, Inc. New York: 1975. Sablon:ISBN.
- ↑ Sablon:Greenwood&Earnshaw2nd pp 151-195
- ↑ Sablon:Cotton&Wilkinson6th
- ↑ Lipscomb W. N. Boron Hydrides. Benjamin, New York (1963).
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Greenwood&Earnshaw2nd p. 162
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Greenwood&Earnshaw2nd p. 177, „The concept of boranes as ligands”,
- ↑ Sablon:Greenwood&Earnshaw2nd p. 171
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite book
Forráshivatkozás-hiba: <ref> címkék léteznek a(z) „*” csoporthoz, de nincs hozzá <references group="*"/>