Foszfátion
Sablon:ChemboxA foszfátion szervetlen, összetett anion, kémiai képlete Sablon:Chem. A foszfátok foszfátiont tartalmazó vegyületek, a foszforsav sói. A szerves kémiában foszfát alatt a foszforsav észtereit értjük. Ezek a vegyületek biológiai szempontból rendkívül jelentősek, például foszforsavészterek alkotják az RNS és DNS vázát, de foszforsav-észterek az alapjai számos növényvédőszernek és idegméregnek is.
Szerkezet és kémiai tulajdonságok
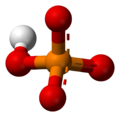
A foszfátion egy foszfor- és négy oxigénatomból áll, melyek a központi foszforatom körül szabályos tetraédert formálva helyezkednek el. A foszfátion töltése háromszorosan negatív, benne a foszfor oxidációs száma +5. Molekulatömege 94,97 g/mol. A foszfátion a hidrogén-foszfát anion (Sablon:Chem) konjugált bázisa, ami a dihidrogén-foszfát anion (Sablon:Chem) konjugált bázisa, amely pedig a foszforsav (Sablon:Chem) konjugált bázisa.
-
Sablon:Chem Foszforsav -
Sablon:Chem Dihidrogén-foszfát -
Sablon:Chem Hidrogén-foszfát -
Sablon:Chem Foszfát
Vizes oldatban mind a négy formában jelen lehet a pH értékének függvényében.

Erősen bázikus közegben a foszfátion (Sablon:Chem) van jelen túlsúlyban, enyhén bázikus közegben a hidrogén-foszfát (Sablon:Chem), enyhén savas közegben a dihidrogén-foszfát a leggyakoribb, míg erősen savas közegben a foszforsav (Sablon:Chem) dominál. Az átalakulás az alábbi egyensúlyi reakciók szerint megy végbe:
A reakciókhoz tartozó egyensúlyi állandók (standard körülmények között):
- (pKs1 2,12)
- (pKs2 7,21)
- (pKs3 12,67)
Ha a foszfátion valamely negatív töltésű oxigénatomjához kation csatlakozik, foszfátok keletkeznek. A foszfátok a foszforsavból származtatott sóknak tekinthetők. A legtöbb foszfát standard nyomáson és hőmérsékleten rosszul oldódik vízben, leszámítva a nátrium-, kálium-, rubídium-, cézium- és ammónium-foszfátot. A hidrogén- és dihidrogén-szulfátok rendszerint jobban oldódnak, mint a megfelelő foszfátok. A vízben oldódó foszfátok lúgosan hidrolizálnak, jól használhatók vízlágyításra, mivel a vízben oldható kalcium- és magnéziumvegyületeket oldhatatlan csapadékká alakítják.
Előfordulás
A foszfor a természetben leginkább foszfátok formájában található meg. A foszfátok számos ásvány alkotóelemei, melyek nagyobb mennyiségben találhatók Észak-Amerika déli partvidékén, főként Floridában, Nauru szigetén, Egyiptomban, Tunéziában, Marokkóban, Izraelben, Jordániában és Kongóban.
Források
- Bodor Endre: Szervetlen kémia I., Tankönyvkiadó, Budapest, 1983 Sablon:ISBN