ATP-szintáz
AZ ATP-szintáz az adenozin-trifoszfát (ATP) adenozin-difoszfátból és szervetlen foszfátból (Pi) való előállítását katalizáló molekula. A katalizált reakció:
Az ATP-szintáz a sejtmembránon keresztül nyílást alkot, ahol a protonok áthaladhatnak a magas koncentrációjú térrészből az alacsony koncentrációjú felé, energiát adva az ATP-szintézishez. Ezen elektrokémiai gradienst az elektrontranszportlánc adja, és lehetővé teszi a sejtek energiatárolását ATP-ben. Prokariótákban az ATP-szintáz a sejtmembránon, eukariótákban a belső mitokondriális membránon terjed át. A fotoszintézisre képes élőlények tilakoid membránjában (mely növények esetén a kloroplasztiszban, cianobaktériumokban a citoplazmában van) is van ATP-szintáz.
Az eukarióta ATP-szintázok F-ATPázok, melyek az ATPázhoz képest „fordítva” működnek. Ez 2 fő egységből áll (FO és F1), az ATP-szintézist lehetővé tevő forgó motormechanizmussal.[1][2]
Nevezéktan
Az F1 rövidítés a „Fraction 1” kifejezésből, az FO egy természetes eredetű antibiotikumot, az oligomicint kötő képességéből származik, mely az FO egységet gátolja.[3][4] Ezek különböző fehérjealegységekből állnak. Az enzim az aerob légzéssel való ATP-előállításban vesz részt.
Szerkezet és működés

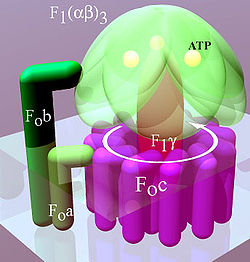

A tilakoid és a belső mitokondriális membránban lévő ATP-szintáz 2 részből (FO és F1) áll. Az FO forgatja F1-et, és c-gyűrűből és a, két b és F6 egységből áll. Az F1 α, β, γ és δ részekből áll. Vízoldékony része van, mely képes az ATP hidrolízisére. Az FO főképp hidrofób részekből áll. Az FO F1 a protonok membránon való áthaladására ad lehetőséget.[7]
F1
Az F1 rész hidrofil és az ATP-hidrolízisért felel. A mitokondriális mátrixba lóg. Az α és β részek 6 kötőhelyű hexamert alkotnak. Ebből 3 inaktív, és ADP-t köt.
3 más egység katalizálja az ATP-szintézist. A többi F1-egység, a γ, a δ és az ε alkotják a tengelyt. A γ a β konformációs változásait (zárt, félnyílt, nyílt állapotok közt) teszi lehetővé, mely az ATP-kötést és a szintézise utáni -felszabadítást teszi lehetővé. Az F1 nagy, és negatív színezéssel látható transzmissziós elektronmikroszkópban.[8] Ezek 9 nm-es részecskék a belső mitokondriális membránban.
| Alegység | Humán gén | Megjegyzés |
|---|---|---|
| α | ATP5A1, ATPAF2 | |
| β | ATP5B, ATPAF1 | |
| γ | ATP5C1 | |
| δ | ATP5D | A mitokondriális δ a bakteriális/kloroplasztisz-ε. |
| ε | ATP5E | Csak mitokondriumokban van jelen. |
| OSCP | ATP5O | Baktériumokban és kloroplasztiszban δ. |
FO

Az FO vízben oldhatatlan fehérje 8 alegységgel és transzmembrán gyűrűvel. A gyűrű tetramer, hélix-gyűrű-hélix fehérje, melynek konformációja protonáláskor és deprotonáláskor változik, a környező alegységek forgását okozva, ami az FO forgását okozza, ami az F1 konformációját is változtatja, így az α és β alegységek állapota váltakozik. Az FO rész protonpórus a mitokondriális membránban. 3 fő alegységből (a, b és c) áll. Hat c egység alkotja a gyűrűt, a b alegység az F1 OSCP-hez csatlakozó tönköt alkot, megakadályozva az αβ hexamer forgását. Az a alegység a b-t a c gyűrűhöz csatlakoztatja.[11] A humán ATP-szintáz 6 további részt tartalmaz (d, e, f, g, F6 és 8 (vagy A6L)). Ezen enzimrész a mitokondrium belső membránjában van, és a protontranszlokációt az ATP-szintézist okozó forgáshoz kapcsolja.
Az eukariótákban a mitokondriális FO membránhajlító dimereket alkot. Ezek a cristák végén hosszú sorokká állnak, feltehetően a cristaképzés első lépéseként.[12] Az élesztő FO részének modellje krio-EM-mel meghatározható 3,6 Å felbontással.[13]
| Alegység | Humán gén |
|---|---|
| a | MT-ATP6 |
| b | ATP5F1 |
| c | ATP5G1, ATP5G2, ATP5G3 |
Kötésmodell


Az 1960-as–1970-es években Paul Boyer, a UCLA professzora kifejlesztette a kötésváltás- (flip-flop) mechanizmuselméletet, mely szerint az ATP-szintézis az ATP-szintáz γ részének forgása okozta konformációváltozása miatt történik. John E. Walker, a cambridge-i MRC Laboratory of Molecular Biology akkori dolgozója az F1 domént kristályosította. Ez, az akkori legnagyobb ismert aszimmetrikus fehérje jelezte, hogy Boyer forgókatalízis-modellje lényegében helyes volt. Ezért Boyer és Walker megosztva kapták az 1997-es kémiai Nobel-díjat.
Az F1 kristályszerkezete 3 váltakozó α és β egységet mutatott, narancsszeletenként elrendezve forgó aszimmetrikus γ alegység körül. Az ATP-szintézis váltakozó katalitikus modellje szerint az elektrontranszportlánc által szállított protonok okozta transzmembrán potenciál a protonokat a membránközi térből a membránon át helyezi az ATP-szintáz FO része révén. Ennek egy része (a c-egységek gyűrűje) forog a protonok áthaladásakor. A c-gyűrű szorosan kapcsolódik a nagy részt a γ alegység által alkotott aszimmetrikus központi tönkhöz, mely forgást okoz az F1 α3β3 részén, a 3 katalitikus nukleotidkötő hely ATP-szintézist okozó konformációváltozásait okozva. A fő F1-alegység központi tönkkel való együtt forgását egy perifériás tönk akadályozza, mely az α3β3 részt az FO nem forgó részéhez kapcsolja. Az érintetlen ATP-szintáz szerkezete jelenleg kis felbontásban ismert elektron-kriomikroszkópia révén. A krio-EM-modell alapján a perifériás tönk rugalmas szerkezet, mely a komplexen át halad, ahogy az F1-et FO-hoz köti. Megfelelő körülmények közt az enzimreakció megfordítható, ahol az ATP-hidrolízis adja a protonpumpa-funkciót a membránon át.
A kötésváltás-mechanizmus a β egység aktív helyének 3 állapot közti váltakozását tartalmazza.[14] „Laza” állapotban ADP és foszfát lépnek be az aktív helybe. Az enzim alakja megváltozik, ezeket összekapcsolja, az aktív hely a így létrejött „szoros” állapotban az új ATP-t nagyon nagy affinitással köti. Végül az aktív hely visszaalakul nyitott állapotba, kiengedve az ATP-t, és további ADP-t és foszfátot kötve, készen a következő ATP-termelési állapotra.[15]
Fiziológiai szerep
Más enzimekhez hasonlóan az ATP-szintáz aktivitása is megfordítható. Elegendően sok ATP transzmembrán protongradienst okoz, ezt használják az elektrontranszportlánc nélküli baktériumok, melyek hidrolizálják az ATP-t a protongradienshez, melyet ostoraik működtetésére és a tápanyagok sejtbe juttatására használnak.
A lélegző baktériumok esetén az ATP-szintáz általában fordítva működik, létrehozva az ATP-t energiaforrásként az elektrontranszportlánc által létrehozott protongradiens révén. E folyamaz az oxidatív foszforiláció. E folyamat megy végbe a mitokondriumokban is, ahol az ATP-szintáz a belső mitokondriális membránban van, az F1 a mitokondriális mátrixba nyúlik. A protonok mátrixba kerülésével az ATP-szintáz ADP-t alakít ATP-vé.
Fejlődés
Az ATP-szintáz evolúciója feltehetően moduláris volt, ahol 2 funkcionálisan független egység asszociálódott és új funkciót szerzett.[16][17] Ez korán történt az evolúcióban, mivel gyakorlatilag egyazon szerkezet és aktivitás van jelen az élet minden országában.[16] Az F-ATP-szintáz nagy funkciós és mechanikai hasonlóságot mutat a V-ATPázhoz.[18] Azonban míg az F-ATP-szintáz protongradienst használ ATP-szintézishez, a V-ATPáz ATP-t használ fel a protongradienshez, akár 1-es pH-t is előállítva.[19]
Az F1 hasonlít a hexamer DNS-helikázokhoz (különösen a ρ-faktorhoz), kapcsolatban áll a protonok működtette T3SS komplexszel,[20] és hasonlít az ostormotorkomplexekre.[18][21][22] Az α3β3 hexamer szerkezete nagymértékben hasonlít a hexamer DNS-helikázokra a 3 fogású szimmetriájú gyűrű és a központi pórus révén. Szerepük a makromolekula forgásától függ, a DNS-helikázok a hélix alakú DNS-t használják a DNS-en való mozgáshoz és a szupertekeredés észleléséhez, míg az α3β3 hexamer a γ egység forgása okozta konformációváltozásokat enzimatikus reakcióhoz használja.[23]
A Sablon:Chem-motor hasonlít az ostorokat működtető Sablon:Chem-motorokhoz.[18] Mindkettő sok kis α-hélix fehérjéből álló gyűrűt tartalmaz, és a közeli álló fehérjékhez képest forognak protongradienst használva energiaforrásként. Ez azonban megtévesztő, mivel az ostormotorok összetettebbek az FO-nál, és a 30 fehérjés gyűrű nagyobb a FO-ban található 10, 11 vagy 14 helikális fehérjénél. 2016-os adatok szerint azonban a gyűrű és a tönk hasonlítanak az F1-hoz.[22]
Fájl:ATP synthesis - ATP synthase rotation.ogv A modulárisevolúció-elmélet szerint 2 független funkciójú alegység, egy ATPázként működő DNS-helikáz és egy protonmotor össze tudtak kapcsolódni, és a motor forgása az ATPázaktivitást fordította meg.[16][23] Ez később egyre hatékonyabbá vált, és a mai összetett ATP-szintázokká alakult. Egy másik lehetőség, hogy a DNS-helikáz/protonmotor komplex protonpumpa volt, ahol az ATPázaktivitás a protonmotort fordította meg.[16] Ez a fordított reakciót adó fehérjévé fejlődött, és ATP-szintázzá vált.[17][24][25]
Inhibitorok
Számos természetes és szintetikus ATP-szintáz-inhibitor ismert.[26] Ezek használhatók az ATP-szintáz szerkezetének és mechanizmusának vizsgálatára. Egyesek terápiás céllal is használhatók. Több ATP-szintáz-inhibitor-osztály van, például peptidinhibitorok, polifenolok, poliketidek, ónorganikus vegyületek, polién-α-piron-származékok, kationos inhibitorok, szubsztrátanalógok, aminosav-módosítók stb.[26] Két gyakran használt ATP-szintáz-inhibitor az oligomicin és az DCCD.
Különböző élőlényekben
Baktériumokban
Az E. coli ATP-szintáza a legegyszerűbb ismert ATP-szintáz, 8 különböző alegységtípussal.[11]
A bakteriális F-ATPázok adott esetben fordítva működhetnek, ATPázzá válva.[27] Egyes baktériumoknak nincs F-ATPázuk, helyette két irányban használnak A/V-típusú ATPázt.[9]
Élesztőben
Az élesztőé az egyik legjobban tanulmányozott eukarióta ATP-szintáz, benne 5 F1, 8 FO egységet és 7 asszociált fehérjét azonosítottak.[7] Ezek legtöbbjének van homológja más eukariótákban.[28][29][30][31]
Növényekben
A növényekben az ATP-szintáz jelen van a kloroplasztiszban (CF1FO-ATP-szintáz). Ez a tilakoid membránba van integrálva, a CF1 a stromába nyúlik, ahol a fotoszintézis sötét része (Calvin-ciklus) és az ATP-szintézis történik. A kloroplasztisz-ATP-szintáz szerkezete és katalitikus mechanizmusa hasonlít a bakteriálisra, azonban a kloroplasztiszban az elektrokémiai potenciált nem az elektrontranszportlánc adja, hanem elsődleges fotoszintetikus fehérjék. A szintáz γ-egysége 40 aa részt tartalmaz a sötétben való felesleges aktivitás gátlására.[32]
Emlősökben
A marhaszív-mitokondriumok ATP-szintáza, a humán ATP-szintáz közeli homológja az egyik legjobban jellemzett ATP-szintáz. A szív a szívizomban lévő sok mitokondrium miatt használatos.[33][34][35]
A humán ATP-szintáz-részeket kódoló gének:
- ATP5A1
- ATP5B
- ATP5C1, ATP5D, ATP5E, ATP5F1, ATP5G1, ATP5G2, ATP5G3, ATP5H, ATP5I, ATP5J, ATP5J2, ATP5L, ATP5O
- MT-ATP6, MT-ATP8
Más eukariótákban
Egyes divergens csoportokba tartozó eukariótákban speciális ATP-szintázok találhatók. Az Euglenozoa ATP-szintáza dimert alkot bumeráng alakú F1-gyel más mitokondriális ATP-szintázokhoz hasonlóan, de az FO sok egyedi egységet tartalmaz. Kardiolipint használ. A gátló IF1 is másképp kötődik – a Trypanosomatida csoporthoz hasonlóan.[36]
Archeákban
Archeákban jellemzően nincs F-ATPáz. Ehelyett A-ATPáz/szintázzal, a V-ATPázhoz hasonló, de főképp ATP-szintázként működő forgó szerkezettel állítanak elő ATP-t.[27] A bakteriális F-ATPázhoz hasonlóan feltehetően ATPázként is működik.[9]
LUCA-ig
Az F-ATPáz-génkapcsolat és -sorrend állandó a prokariótákban, tehát az utolsó közös ős, LUCA előtt is létezett a rendszer.[37]
Jegyzetek
Fordítás
Források
- Nick Lane: The Vital Question: Energy, Evolution, and the Origins of Complex Life, Ww Norton, 2015-07-20, Sablon:ISBN (Link points to Figure 10 showing model of ATP synthase)
További információk
- Boris A. Feniouk: "ATP synthase — a splendid molecular machine"
- Well illustrated ATP synthase lecture Sablon:Wayback by Antony Crofts of the University of Illinois at Urbana–Champaign.
- Proton and Sodium translocating F-type, V-type and A-type ATPases in OPM database
- The Nobel Prize in Chemistry 1997 to Paul D. Boyer and John E. Walker for the enzymatic mechanism of synthesis of ATP; and to Jens C. Skou, for discovery of an ion-transporting enzyme, Sablon:Chem, Sablon:Chem-ATPase.
- Harvard Multimedia Production Site — Videos – ATP synthesis animation
- David Goodsell: "ATP Synthase- Molecule of the Month" Sablon:Webarchive
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:PDB, Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ 7,0 7,1 Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ 9,0 9,1 9,2 Sablon:Cite journal
- ↑ Sablon:PDB; Sablon:Cite journal
- ↑ 11,0 11,1 Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ 16,0 16,1 16,2 16,3 Sablon:Cite journal
- ↑ 17,0 17,1 Sablon:Cite web
- ↑ 18,0 18,1 18,2 Sablon:Cite web
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ 22,0 22,1 Sablon:Cite journal
- ↑ 23,0 23,1 Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ 26,0 26,1 Sablon:Cite journal
- ↑ 27,0 27,1 Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal
- ↑ Sablon:Cite journal Sablon:Cite web
- ↑ Sablon:Cite journal