Cink-acetát
A cink-acetát a cink ecetsavas sója, a képlete Zn(O2CCH3)2. Gyakran mint dihidrát fordul elő (Zn(O2CCH3)2·2H2O). Az anhidrát és a dihidrát is színtelen, a kémiai szintézisben és étrendkiegészítőkben gyakran használt szilárd anyag. Élelmiszeradalékként használva E kódszáma E650.
Története
A cink-acetátot talán már Geber alkimista is ismerte a VIII. században; gyógyszerül Rademacher ajánlotta.
Jellemzői
Színtelen, átlátszó, gyöngyházfényű, gyengén ecetsavszagú kristályokból áll; hideg vízben könnyen feloldódik, a borszesz is elég jól oldja. A levegőn kissé elmállik, 100 °C-on az összes kristályvizét elveszíti. Erősebb hevítéskor elbomlik.
Bázisos cink-acetát
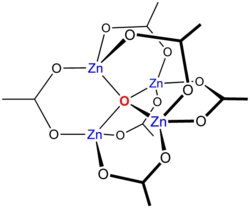
Vízmentes cink-acetátot vákuumban hevítve ecetsavanhidrid kilépés közben egy klasztervegyület, „bázisos cink-acetát”, Zn4O(CH3CO2)6 keletkezik. Ennek tetraéderes szerkezete az alábbi ábrán látható. Nagyon hasonlít a berillium analóg vegyületére (Be4O(OAc)6), bár a Zn–O kötéstávolság valamivel nagyobb, 197 pm a Be–O 163 pm-jével szemben.[1]
Előállítása, felhasználása
Előállítható cink-oxid vagy cink-karbonát ecetsavval való reakciója által.
- Cink-oxid és ecetsav reakciója cink-acetát és víz keletkezése közben.
- Cink-karbonát és ecetsav reakciója cink-acetát, szén-dioxid és víz keletkezése közben.
Az iparban fa konzerválására, más cink sók, polimerek, etilén-acetát előállítására, festékekhez pácként és analitikai reagensként használják.
Élettani tulajdonságai
Óvintézkedések
Források
Hivatkozások
- ↑ Koyama, H.; Saito, Y. “The Crystal Structure of Zinc Oxyacetate, Zn4O(CH3COO)6” Bulletin of the Chemical Society of Japan, 1954, volume 27, pages 112-114.