Enzimszubsztrát

Az enzim által katalizált reakció kiindulási vegyületét szubsztrátnak nevezik. Az enzim a biokémiai reakcióban ezen a molekulán fejti ki a hatását, megváltoztatva annak szerkezetét. Az enzim és szubsztrát közötti kapcsolatot gyenge, reverzibilis kölcsönhatások (elektrosztatikus kötések, H-hidak, hidrofób kölcsönhatások) biztosítják.[1]
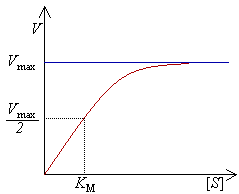
A biokémia legismertebb enzimkinetikai modellje szerint az enzimatikus reakció sebessége egyetlen szubsztrát esetén a szubsztrát koncentrációjának függvénye:
ahol az a maximális sebesség, amely maximális szubsztrátkoncentrációnál jön létre. Ez gyakorlatilag szubsztrátra nézve telített oldatnak felel meg. A Michaelis konstans az a szubsztrátkoncentráció, amelynél a reakció sebessége a fele. Ha az enzimreakció sebességét a szubsztrát-koncentráció függvényében meghatározzuk és az eredményeket a koordináta-rendszerben ábrázoljuk, akkor egy hiperbolát kapunk.
Kulcs-zár modell
Az enzim aktív centruma, azaz a szubsztrátkötő hely a kapcsolat létrejötte előtt is már megfelel a szubsztrát alakjának, készen áll a szubsztrát fogadásához. A kapcsolódás során az enzim geometriája nem változik.
Indukált illeszkedés
A szubsztrát és a szubsztrátkötő hely közötti kölcsönhatás formálja ki a kapcsolat létrejöttéhez szükséges optimális szerkezetet, azaz a kapcsolódás során megváltozik az enzim geometriája.